
Ngày nay, kỹ thuật di truyền đã được ứng dụng khá phổ biến trong lai tạo, hình thành nhiều loại cây trồng mang những tính trạng mong muốn, phục vụ hữu hiệu cho yêu cầu đảm bảo an ninh lương thực. Cà chua có thời gian bảo quản lâu hơn, gạo giàu vitamin A, đu đủ kháng bệnh đốm vòng do virus, lúa chịu hạn,… là những ví dụ về cây trồng biến đổi gene nổi bật, được lai tạo bằng kỹ thuật di truyền.
Kỹ thuật di truyền đề cập đến việc tác động đến vật liệu di truyền, chủ yếu là DNA, để thay đổi, sửa chữa hoặc cải thiện các hình dáng, chức năng của sinh vật. Kỹ thuật di truyền gồm các giải pháp như chuyển gene và thiết kế, chỉnh sửa gene.
Kỹ thuật chuyển gene
Chuyển gene (transgenesis) là đưa một đoạn DNA ngoại lai vào genome của một cơ thể đa bào, sau đó đoạn DNA ngoại lai này sẽ có mặt ở hầu hết các tế bào và được truyền lại cho thế hệ sau. Nhà tạo giống có thể cùng lúc đưa vào cây trồng những gene mong muốn, có nguồn gốc từ những cơ thể sống khác nhau (không chỉ giữa các loài có họ gần nhau mà còn ở những loài rất xa nhau) để thu được giống mới nhanh hơn mà không bị các giới hạn của kỹ thuật tạo giống truyền thống.
Quá trình phát triển kỹ thuật chuyển gene ở thực vật đã trải qua nhiều cột mốc quan trọng: Năm 1980, lần đầu tiên DNA ngoại lai (transposon Tn7) được chuyển vào thực vật. Năm 1983, nhiều nhóm nghiên cứu đã biến đổi T-DNA và đưa DNA ngoại lai vào để tạo ra tính kháng một số chất kháng sinh. Năm 1984, biến nạp bằng tế bào trần (protoplast) ở ngô được thực hiện. Năm 1985, cây biến đổi gene có tính kháng thuốc diệt cỏ ra đời. Năm 1986, các nhà nghiên cứu đã thành công trong việc tạo ra thực vật kháng virus. Năm 1987, phương pháp biến nạp phi sinh học được sử dụng. Chuyển gene thành công ở các cây một lá mầm quan trọng như lúa (1988), ngô (1990) và lúa mỳ (1992). Năm 1994, cà chua Flavr SavrR là cây trồng đầu tiên biến đổi gene đã được thương mại hóa.
Chuyển gene thông qua vi khuẩn Agrobacterium
Là tác nhân gây bệnh trên thực vật, sự lây nhiễm bệnh của Agrobacterium tumefaciens dẫn đến biến đổi gene của tế bào chủ, thông qua sự tích hợp ổn định vào bộ gene của vật chủ bởi một đoạn DNA gọi là T-DNA. Với khả năng độc đáo trong việc chuyển DNA, Agrobacterium tumefaciens đã được sử dụng rộng rãi như một công cụ của kỹ thuật di truyền.
Agrobacterium tumefaciens thường tồn tại trong đất hoặc trên các mảnh vụn thực vật và xâm nhập vào cây trồng qua vết thương trên vỏ cây hoặc qua các cấu trúc tự nhiên như rễ hoặc lá, sử dụng các pili và các cơ chế khác để xâm nhập vào tế bào thực vật, sau đó truyền T-DNA vào tế bào thực vật. T-DNA này mang các gene có khả năng gây ra sự phát triển không kiểm soát của tế bào, tạo ra các u tuyến (hay u củ) trên rễ hoặc thân cây. T-DNA chứa các gene kích thích quá trình tổng hợp phytohormone (hormon thực vật) như auxin và cytokinin. Điều này dẫn đến sự phân chia tế bào quá mức và tạo thành các khối u, tác động đến sự phát triển bình thường của cây.
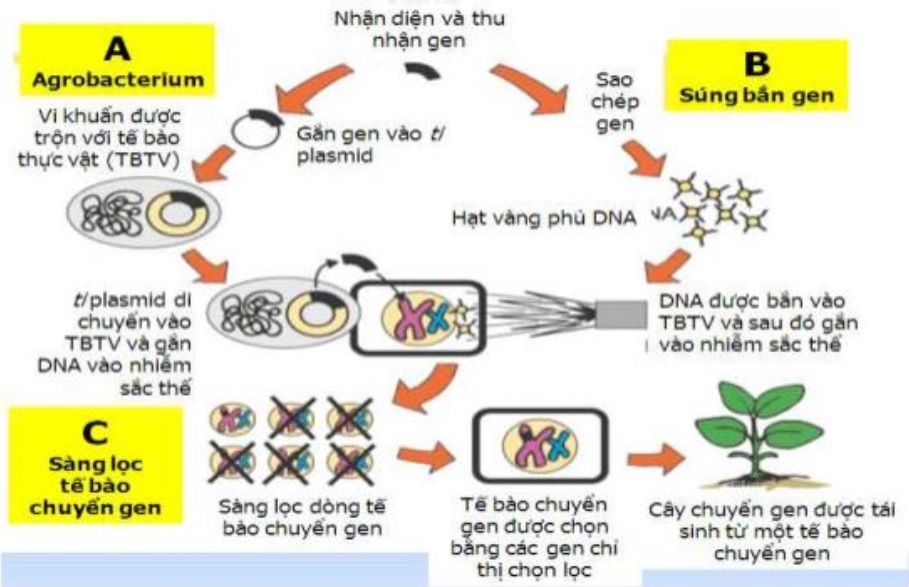
Phương pháp biến nạp thông qua chủng vi khuẩn Agrobacterium (gián tiếp) và súng bắn gene (trực tiếp) (Nguồn: cesti.gov.vn)
Chuyển gene thông qua biện pháp điện di
Sử dụng điện cũng là phương cách để các nhà khoa học thực hiện chuyển gene, trong đó, phương pháp điện di dựa trên nguyên tắc dùng xung điện tác động lên màng tế bào, làm thay đổi cấu trúc màng tế bào, tạo ra các lỗ tạm thời trên màng tế bào để tạo điều kiện cho vật liệu di truyền đi qua. Tại Trung Quốc, điện di đã được sử dụng hiệu quả để đưa DNA vào mô của phôi lúa mì non còn nguyên vẹn. Các thông số vật lý của điện di là cường độ trường 770 V/cm, tụ điện 800 microF và 100 microg/mL DNA plasmid, chứa thanh và gene GUS. Điện di được thực hiện bằng điện cực vòng di động và cố định có thể lắp vào các giếng của đĩa 24 giếng.
Tại Việt Nam, kỹ thuật chuyển gene đã được các nhà khoa học ứng dụng vào thực tiễn trong việc tạo ra các giống kháng bệnh virus, kháng sâu và tăng năng suất trên các loài cây mang lại nhiều lợi ích kinh tế như cây bông, cà chua, đậu tương, lúa,… Năm 2015, TS. Đặng Thị Vân (Viện Nghiên cứu Rau quả) đã thành công trong việc “Nghiên cứu ứng dụng kỹ thuật chuyển gene trong tạo giống kháng bệnh virus xoăn vàng lá cà chua của Việt Nam”, chuyển gene mục tiêu kháng vius xoăn vàng lá theo đường hướng RNAi, ứng dụng lây nhiễm nhân tạo virus xoăn vàng lá cà chua thông qua Agrobacterium tumefaciens cho giống cà chua DM 166 và M88.
Năm 2016, TS. Trịnh Minh Hợp (Viện Nghiên cứu Bông và Phát triển nông nghiệp Nha Hố) đã tạo được 26 dòng bông chuyển gene (mỗi dòng 30 cây) kháng sâu (tỷ lệ giết sâu xanh, sâu da láng và sâu khoang ≥ 80%) và chịu thuốc trừ cỏ gốc glyphosate qua “Nghiên cứu tạo giống bông kháng sâu và chịu thuốc trừ cỏ bằng kỹ thuật chuyển gen”. Các nhà khoa học đã xây dựng quy trình chuyển gene kháng sâu và chịu thuốc trừ cỏ vào giống Coker310 bằng phương pháp chuyển gene gián tiếp thông qua Agrobacterium tumefaciens; quy trình chuyển gene kháng sâu và chịu thuốc trừ cỏ vào giống MCU9 bằng phương pháp vi tiêm vào bầu nhụy thông qua đường ống phấn, cho hiệu quả chuyển gene 0,5-1,0%.
Ở Trường Đại học Nông Lâm TP.HCM, năm 2023, PGS.TS. Trần Văn Điền cũng đã thành công trong việc “Nghiên cứu tạo giống đậu tương chuyển gen kìm hãm già hóa bộ lá và tăng kích thước hạt”, với các kết quả: thiết kế được 2 vector chuyển gene mang gene kìm hãm già hóa ore1 và tăng kích thước hạt BS1; thực hiện chuyển gene thành công vào một số giống đậu tương khu vực miền núi phía Bắc; tạo ra 15 cây đậu tương T1 hoặc T2 mang gene ore1; 15 cây đậu tương T1 hoặc T2 mang gene BS1. Kết quả của nhiệm vụ có ý nghĩa khoa học và thực tiễn cao, góp phần nâng cao hiệu quả tạo giống, đồng thời rút ngắn thời gian, giảm chi phí trong chọn tạo giống so với các phương pháp chọn tạo giống thông thường. Các dòng đậu tương chuyển gene có kích thước hạt lớn hơn so với đối chứng, có thể tiếp tục bồi dưỡng và phát triển thành giống mới có năng suất cao, từ đó gia tăng hiệu quả kinh tế cho nông dân.
Kỹ thuật chỉnh sửa gene
Chỉnh sửa bộ gene là phương pháp cho phép các nhà khoa học thay đổi DNA của nhiều loài sinh vật (động vật, thực vật và vi khuẩn). Ở thực vật, chỉnh sửa DNA có thể dẫn đến những thay đổi về tính trạng (màu sắc, hình dạng, kích thước,…). Một số công nghệ chỉnh sửa gene nổi tiếng được biết đến ngày nay là ZFN, TALEN, CRISPR, BE. Các nhà khoa học sử dụng các công nghệ này để thực hiện việc này tạo ra những thay đổi trên trình tự gene nội sinh theo cách có chủ đích, tại một vị trí xác định.
TALEN- Enzyme cắt DNA giống yếu tố hoạt hóa phiên mã
Năm 2011, lần đầu tiên công nghệ TALEN được sử dụng để chỉnh sửa gene thực vật. Công nghệ này dựa trên việc sử dụng các nuclease được thiết kế. Tức là, các protein nhân tạo bao gồm một miền liên kết DNA đặc hiệu trình tự có thể tùy chỉnh được hợp nhất với một nuclease cắt DNA theo cách không đặc hiệu trình tự. Các nuclease có thể nhắm mục tiêu này được sử dụng để tạo ra các đứt gãy sợi đôi (DSB) vào các vị trí DNA cụ thể, sau đó được sửa chữa bằng các cơ chế có thể khai thác để tạo ra các thay đổi trình tự tại vị trí cắt. TALEN là công cụ có tính chính xác cao, độ tin cậy và hiệu suất trên 80%. Hơn nữa, TALEN có hiệu quả chỉnh sửa tốt hơn CRISPR.
CRISPR
CRISPR (viết tắt của “Clustered Regularly Interspaced Short Palindromic Repeats”) là công nghệ dùng để sửa đổi có chọn lọc DNA của các sinh vật sống. Thuật ngữ này mô tả “hình dạng di truyền” của một hệ thống phát hiện được ở vi khuẩn từ năm 1987. Đến năm 2005, các nhà nghiên cứu đã phát hiện CRISPR là một hệ thống miễn dịch, được vi khuẩn sử dụng để bảo vệ bản thân khỏi virus thông qua việc nhận dạng, ngăn chặn và loại bỏ virus. Năm 2012, lần đầu tiên CRISPR được ứng dụng trong kỹ thuật chỉnh sửa hệ gene, với công trình nghiên cứu của nhóm tác giả Jennifer Doudna và Emmanuelle Charpentier (Trường Đại học California). Nhóm tác giả này đã đưa vào trong tế bào một phức hệ bao gồm enzyme Cas9 nuclease và RNA dẫn đường (guide RNA) tự thiết kế để cắt đoạn DNA tại những vị trí mong muốn.
CRISPR/Cas9 chỉnh sửa gene bằng cách cắt chính xác DNA, sau đó thực hiện các quá trình sửa chữa DNA tự nhiên để sửa đổi gene theo nhu cầu. Hệ thống này gồm hai thành phần: enzyme Cas9 nuclease và RNA dẫn đường. Nhờ đoạn trình tự bổ sung của RNA dẫn đường với trình tự đích mà phức hợp này có thể tìm thấy vị trí cần chỉnh sửa trên hệ gene. Để có thể hoạt động, hệ thống CRISPR còn yêu cầu một trình tự ngắn từ 2-5 nucleotides trên DNA đích (được gọi là protospacer associated motif - PAM) ngay sau đoạn bổ sung của RNA dẫn đường (đối với CRISPR/Cas9 của vi khuẩn S. pyogenes thì trình tự này là 5’-NGG, trong đó N là bất kỳ nucleotide nào). Khi phức hợp enzyme Cas9 và RNA dẫn đường bám vào trình tự đích, enzyme Cas9 sẽ dùng hai tiểu phần HNH và RuVC của mình để cắt đoạn DNA trên cả hai mạch tại vị trí nucleotide thứ 3-4 phía trước PAM. Công cụ CRISPR được ví như một chiếc “kéo sinh học”, giúp các nhà khoa học có thể dùng để “phẫu thuật phân tử” - cắt một cách chính xác tại vị trí mong muốn - và từ đó, giúp chỉnh sửa hệ gen trong tế bào.
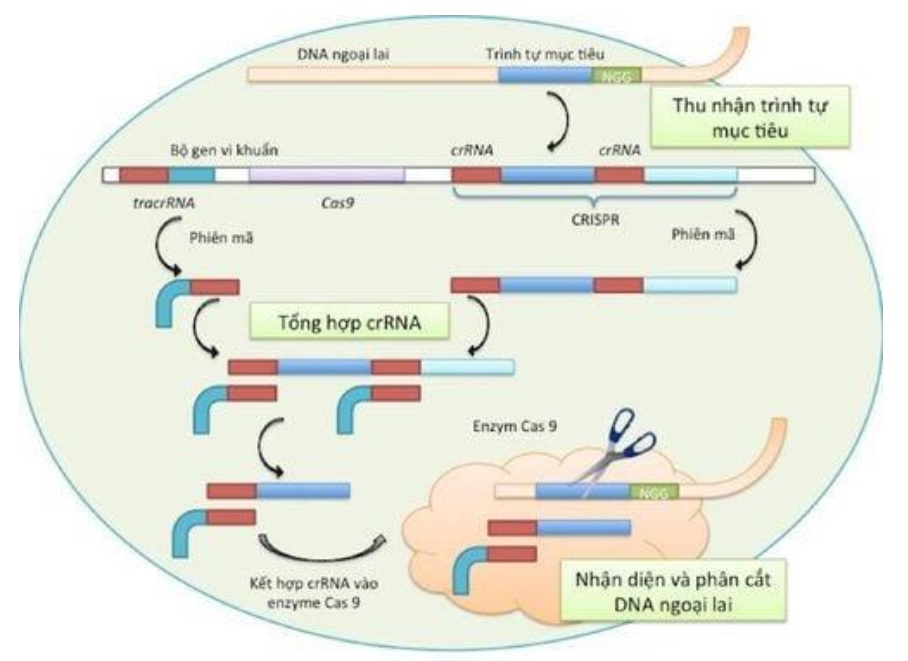
Hệ thống CRISPR/Cas9 (nguồn: vinmec.com)
BE - Hệ thống chỉnh sửa base
BE là hệ thống kết hợp vùng CRISPR/Cas9 bất hoạt (là các biến thể của Cas9 như dCas9 hoặc Cas9 nickase) và cytidine deaminase hoặc adenine deaminase, lần đầu tiên được áp dụng thành công trong các tế bào động vật. Năm 2016, Komor và các cộng sự đã thiết kế cấu trúc kết hợp CRISPR/Cas9 và enzyme cytidine deaminase có khả năng duy trì sự dẫn của RNA nhưng không cắt sợi đôi DNA (hay còn gọi là Cas9 bất hoạt - dCas9 mang đột biến D10A và H840A) mà làm trung gian chuyển đổi trực tiếp cytidine thành uridine. Cytidine deaminase đầu tiên chuyển đổi cytosine trong DNA thành uracil, sau đó uracil được thay thế bằng thymine trong quá trình sao chép DNA, do đó, có thể chuyển đổi C (cytosine) thành T (thymine) hoặc G (guanine) thành A (adenine). Kết quả là tạo ra hệ thống chỉnh sửa base cytidine (cytidine base editor, CBE), chuyển đổi cytidine trong không gian khoảng 5 nucleotide.
Hệ thống BE thế hệ đầu tiên (BE1) được thiết lập bằng cytidine deaminase APOBEC1 từ chuột liên kết với dCas9 bằng một liên kết 16 amino acid (aa) XtEN. BE thế hệ thứ hai (BE2) đã được phát triển bằng cách thêm chất ức chế uracil glycosylase DNA (UGI) vào đầu C của cấu trúc nhắm DNA mục tiêu (APOBEC-XTENdcas9-UGI). BE thế hệ thứ ba (BE3) bao gồm rAPOBEC1 kết hợp với đầu N của enzyme cắt (nickase) Cas9-D10A bằng XtEN với 16 aa và nối UGI ở đầu C bằng một liên kết 4 aa. Để tiếp tục mở rộng và tăng hiệu quả chỉnh sửa của BE, BE thế hệ thứ tư (BE4) sử dụng Cas9 từ S. pyogenes (SpBE4) và Cas9 từ S. aureus (SaBE4) được phát triển bằng cách liên kết rAPOBEC1 với Cas9-D10A thông qua 32 aa liên kết và hợp nhất hai phân tử UGI với cả hai đầu C và N của Cas9 nickase bởi một liên kết 9 aa.
Công nghệ CRISPR/Cas9 đã được TS. Nguyễn Xuân Dũng (Trung tâm Công nghệ Sinh học TP.HCM) vận dụng vào năm 2022, khi triển khai nhiệm vụ “Nghiên cứu ứng dụng công nghệ chỉnh sửa gen CRISPR/Cas9 trên cây dưa leo (Cucumis sativus L) hướng đến tạo giống dưa leo có khả năng kháng virus”. Các nhà nghiên cứu đã thiết kế vector chỉnh sửa gene eIF4E dựa trên công nghệ CRISPR/Cas9; tạo chủng vi khuẩn Agrobacterium tumefaciens mang vector chỉnh sửa gene và xây dựng quy trình chuyển gene vào cây dưa leo bằng vi khuẩn Agrobacterium tumefaciens. Các nhà khoa học cũng đã tạo một số dòng dưa leo có gene eIF4E được chỉnh sửa, phục vụ đánh giá khả năng kháng virus.
***
Kỹ thuật di truyền có vai trò quan trọng trong việc chọn tạo giống thông qua việc chuyển gene, chỉnh sửa gene để tạo các giống cây trồng có năng suất cao và chất lượng tốt hơn, mang lại nhiều lợi ích trong ngành nông nghiệp. Ngoài ra để chống chịu với môi trường ngày càng khắc nghiệt, các giống cây trồng mới ngày nay còn mang thêm các gene chịu hạn, chịu rét và các điều kiện bất thuận khác. Tại Việt Nam, các nhà nghiên cứu tiếp nhận những kỹ thuật di truyền tân tiến nhất để nghiên cứu tạo giống phù hợp với điều kiện, đặc điểm khí hậu nhằm đáp ứng nhu cầu trong nước và xuất khẩu, chủ yếu là các giống cây lương thực như: lúa, ngô, đậu, họ khoai.
Minh Thư
----------------------------------------
Mời các bạn đón đọc tiếp "Chỉ thị phân tử: Quá trình phát triển và ứng dụng" trong ấn phẩm Thông tin chuyên đề KH,CN&ĐMST số 03/2025.
----------------------------------------
Tài liệu tham khảo:
[1] Dương Văn Cường, Nguyễn Huy Thuần. Sách Giáo trình nguyên lý kỹ thuật di truyền. Đại học Nông Lâm Thái Nguyên
[2] Trần Quốc Dung, Nguyễn Hoàng Lộc, Trần Thị Lệ. Công nghệ chuyển gen (động vật, thực vật). Trường Đại học Sư phạm, Đại học Huế
[3] Science and History of GMOs and Other Food Modification Processes. https://www.fda.gov/food/agricultural-biotechnology/science-and-history-gmos-and-other-food-modification-processes
[4] https://pubmed.ncbi.nlm.nih.gov/32242300
[5] https://www.broadinstitute.org/what-broad/areas-focus/project-spotlight/crispr-timeline
[6] https://www.vinmec.com/vie/bai-viet/tim-hieu-ve-he-thong-chinh-sua-he-gen-crispr-vi
[7]https://nsti.vista.gov.vn/publication/download/hE/qFnsXTyqTyqbGZh.html#:~:text=TALENs%20Transcription%20Activator%2Dlike%20Effector,plant%20breeding%3B%20TALENs%3B%20Genomes
[8] https://pmc.ncbi.nlm.nih.gov/articles/PMC3547402
[9] https://www.synthego.com/learn/genome-engineering-history
